สมดุลเคมี – ค่าคงที่สมดุล
การศึกษาสมดุลเคมี
แนวคิดเกี่ยวกับสมดุลเคมี ได้เริ่มพัฒนาขึ้นหลังจากการศึกษาของ โคล้ด หลุยส์ แบร์โธเล่ต์ (Claude Louis Berthollet) นักเคมีชาวฝรั่งเศส ที่พบว่าปฏิกิริยาเคมีบางชนิดเป็นปฏิกิริยาผันกลับได้(reversible reaction) โดยในสมดุลเคมีนั้น อัตราการเกิดปฏิกิริยาไปข้างหน้า (forward reaction) จะเท่ากับอัตราการเกิดปฏิกิริยาย้อน กลับ (backward หรือ reverse reaction) สมการต่อไปนี้ เป็นการแสดงสมดุลเคมีของปฏิกิริยาระหว่างสาร A และ สาร B เกิดเป็นสาร S และ สาร T โดยที่ α, β, σ และ τ เป็นสัมประสิทธิ์ปริมาณสัมพันธ์ (stoichiometric coefficient) ของปฏิกิริยาดังกล่าว
ถ้าหากปฏิกิริยาเกิดไปข้างหน้าได้มากๆ ความเข้มข้นของสารตั้งต้น A แฃะสาร B เหลือน้อยมากๆ อาจจะกล่าวอีกนัยหนึ่ง คือ มี สมบูรณ์ของปฏิกิริยา (reaction completeness) สูง หรือถ้าปฏิกิริยาย้อนกลับเกิดได้ดีมากๆทำให้ความเข้มข้นของสาร A และสาร B สูงในขณะที่ความเข้มข้นของสาร S และ T น้อยมาก อาจกล่าวได้ว่าปฏิกิริยาเกิดได้ไม่สมบูรณ์ ดังนั้น การอธิบายปฏิกิริยาเคมีในสมดุลจึงสามารถบอกความสมบูรณ์ของปฏิกิริยาได้ ซึ่งการคำนวณจะเกี่ยวข้องกับ ค่าคงที่สมดุลเคมี
ค่าคงที่สมดุล
ในปฏิกิริยาเคมีที่ผันกลับได้ทั่วๆไปต่อไปนี้
ค่าคงที่สมดุลไดนามิกส์ (K![]() )ถูกนิยามขึ้น โดย สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ (IUPAC )[2][3] ดังนี้
)ถูกนิยามขึ้น โดย สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ (IUPAC )[2][3] ดังนี้
เมื่อ {A} คือ แอกทิวิตี (activity)ของสาร A, {B} คือ แอกทิวิตีของสาร B, … ทั้งนี้ การแสดงความสัมพันธ์ข้างต้น เป็นการพิจารณาการเปลี่ยนแปลงพลังงานอิสระกิ๊บส์ (Gibbs free energy) แต่ในทางปฏิบัติแล้ว เรานิยมใช้ความเข้มข้นของสาร อาทิ [A], [B], … มากกว่าการใช้แอกทิวิตี และใช้ ผลหารความเข้มข้น(concentration quotient, Kc) มากกว่า K![]() ดังสมการ
ดังสมการ
เมื่อ Kc เท่ากับค่าคงที่สมดุลทางเทอร์โมไดนามิกส์ หารด้วย ผลหารสัมประสิทธิ์แอกทิวิตี (quotient of activity coefficients) เมื่อมีค่าเท่ากับ 1 จะได้ว่า Kc = K![]()
ค่าคงที่สมดุล (Chemical Equilibrium)
ความสัมพันธ์ระหว่างความเข้มข้นของสารต่างๆ ณ ภาวะสมดุล เมื่อปฏิกิริยาเคมีที่สาร A ทำปฏิกิริยากับสาร B ได้สาร C และสาร D เข้าสู่ภาวะสมดุล
A + B ![]() C + D
C + D
- อัตราการเกิดปฏิกิริยาไปข้างหน้า (Ratef) และอัตราการเกิดปฏิกิริยาย้อนกลับ (Rater) สามารถเขียนได้ดังนี้
- Kf และ Kr คือค่าคงที่ของ Ratef และ Rater ตามลำดับที่ภาวะสมดุล
- Ratef = Rater
- Kf [A] [B] = Kr [C] [D]
- K =
 =
=  [ ] แทนความเข้มข้นเป็น mol/dm3
[ ] แทนความเข้มข้นเป็น mol/dm3 - นิยามของค่าคงที่สมดุล และ การหาค่าคงที่สมดุล (Equilibrium constant)
- ผลคูณของความเข้มข้นของสารผลิตภัณฑ์ที่ยกกำลังด้วยสัมประสิทธิ์บอกจำนวนโมลสารผลิตภัณฑ์ หารด้วยผลคูณของความเข้มข้นของสารตั้งต้น ที่ยกกำลังด้วยสัมประสิทธิ์บอกจำนวนโมลสารตั้งต้น จะมีค่าคงที่ที่อุณหภูมิหนึ่ง คือค่าคงที่สมดุล (Equilibrium constant) และมีสัญลักษณ์เป็น K หรือ Kc
- H2 (g) + I2 (g)
 2HI (g) ที่ภาวะสมดุล K =
2HI (g) ที่ภาวะสมดุล K = 
- 2NO2Cl (g)
 2NO2 (g) + Cl2 (g) K =
2NO2 (g) + Cl2 (g) K = 
- ขั้นตอนการคำนวณเกี่ยวกับค่าคงที่สมดุลเคมี
- 1. เขียนสมการพร้อมดุล
- 2. เขียนความเข้มข้นของสารตั้งต้น
- 3. เขียนความเข้มข้นของสารที่เปลี่ยนไป
- 4. เขียนความเข้มข้นของสารที่ภาวะสมดุล ( จากขั้นที่ 2 + ขั้นที่ 3 )
- 5. เขียนค่าคงที่สมดุลจากขั้นที่ 1
- 6. แทนค่าความเข้มข้นของสารต่าง ๆ ที่ภาวะสมดุล จากขั้นที่ 4 ลงในขั้นที่ 5
- 7. คำนวณหาตัวแปร จากขั้นที่ 6
- 8. ตอบคำถามจากโจทย์ที่กำหนด
- ความสัมพันธ์ระหว่าง ค่า K กับความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ และการดำเนินไปของปฏิกิริยา
- 1. ค่า K > 1 ถือว่า ค่า K มาก แสดงว่า ปฏิกิริยาเกิดไปข้างหน้าได้ดีมาก ผลิตภัณฑ์เกิดมาก สารตั้งต้นเหลือน้อย
- 2. ค่า K < 1 ถือว่า ค่า K น้อย แสดงว่า ปฏิกิริยาเกิดไปข้างหน้าได้น้อย เกิดปฏิกิริยาย้อนกลับได้ดี
- ผลิตภัณฑ์เกิดน้อย สารตั้งต้นเหลือมาก
- 3. ค่า K = 1 ถือว่า ค่า K ปานกลาง แสดงว่า สารตั้งต้นและสารผลิตภัณฑ์ จะมีปริมาณพอ ๆ กัน
- 4. ค่า K จะคงที่เสมอ ไม่ว่าสมดุลจะถูกรบกวน ยกเว้น อุณหภูมิมีการเปลี่ยนแปลง
- 5. ค่า K > 1 หรือ K < 1 ได้ แต่จะไม่มีค่าติดลบ
- สรุปเกี่ยวกับความสัมพันธ์ของค่า K
- 1. สมการเป็นสมการที่กลับข้างสมการเดิม ค่า K ก็เป็นส่วนกลับค่า K ของสมการเดิม หรือเป็นปฏิกิริยาย้อนกลับขอสมาการเดิม
(K =
=  )
) - 2H2 (g) + O2 (g)
 2H2O (g) ; K1 =
2H2O (g) ; K1 = 
- 2H2O (g)
 2H2 (g) + O2 (g) ; K2 =
2H2 (g) + O2 (g) ; K2 = 
- K1.K2 =
 .
. = 1
= 1 - จะได้ว่า K2 =

- 2. ถ้าสมการใหม่ได้จากการคูณสมการเดิมด้วย n ค่า K ของสมการใหม่จะเท่ากับ K ของสมการเดิมยกกำลังด้วย n ( n อาจจะเป็นเลขจำนวนเต็มหรือ เศษส่วนก็ได้ ) K
 =
= 
- เช่น
- 2H2 (g) + O2 (g)
 2H2O (g) ; K1 =
2H2O (g) ; K1 = 
- ถ้าคูณสมการดังกล่าวนี้ด้วย 1/2 จะได้สมการใหม่เป็นดังนี้
- H2 (g) + 1/2 O2 (g)
 H2O (g) ; K3 =
H2O (g) ; K3 = 
- เมื่อพิจารณา K1 และ K3 จะได้ว่า
- K3 = [
 ]
] = (K1)
= (K1)
- 3. ถ้าสมการใหม่ได้จากการรวมสมการ 2 สมการ (สมมติมีค่า K เป็น K1 และ K2 ตามลำดับ) เข้าด้วยกัน ค่า K ของสมการใหม่ จะเท่ากับผลคูณของค่า K ของสมการเดิม K
 = K1 . K2
= K1 . K2 - เช่น 2BrCl (g)
 Cl2 (g) + Br2 (g) ; K1 =
Cl2 (g) + Br2 (g) ; K1 = 
- Br2 (g) + I2 (g)
 2 IBr (g) ; K2 =
2 IBr (g) ; K2 = 
- เมื่อรวมสมการทั้งสองเข้าด้วยกัน จะได้
- 2BrCl (g) + Br2 (g) + I2 (g)
 2 IBr (g) + Cl2 (g) + Br2 (g) ;K3 =
2 IBr (g) + Cl2 (g) + Br2 (g) ;K3 = 
- K3 =
 =
=  .
.
- K3 = K1 . K2
- 4. ถ้าสมการใหม่ได้จากการลบสมการที่ 2 ออกจากสมการที่ 1 ค่า K ของสมการใหม่เท่ากับค่า Kของสมการที่ 1 หารด้วยค่า K ของสมการที่ 2 K
 =
= 
- ค่าคงที่สมดุลในเทอมของความดัน (Kp)
- ในปฏิกิริยาที่สารตั้งต้นและสารผลิตภัณฑ์เป็นก๊าซ ค่าคงที่สมดุลสำหรับระบบของก๊าซจะขึ้นอยู่กับความดันย่อยของก๊าซ ไม่ใช้ความเข้มข้น มีสัญลักษณ์เป็น Kp
- เช่น ปฏิกิริยา N2 (g) + H2 (g)
 2NH3 (g)
2NH3 (g) - KP =
 , P
, P , P
, P และ P
และ P แทนความดันของก๊าซ NH3 , N2 และ H2 ตามลำดับ
แทนความดันของก๊าซ NH3 , N2 และ H2 ตามลำดับ - ความสัมพันธ์ระหว่าง Kp และ Kc
- ค่า Kp และ Kc อาจจะเท่ากันหรือไม่เท่ากันก็ได้ ความสัมพันธ์ระหว่าง Kp และ Kc เป็นดังนี้
- Kp = Kc(RT)

- R = ค่าคงที่ของก๊าซ 0.0823 dm3 . atm . mol-1 . K-1
- T = อุณหภูมิเคลวิน
 = จำนวนโมลของสารผลิตภัณฑ์ (ก๊าซ ) – จำนวนโมลของสารตั้งต้น ( ก๊าซ )
= จำนวนโมลของสารผลิตภัณฑ์ (ก๊าซ ) – จำนวนโมลของสารตั้งต้น ( ก๊าซ )- ถ้า
 = 0 ค่า Kp = Kc
= 0 ค่า Kp = Kc - ค่าคงที่สมดุลของการละลาย
- เมื่อเกลือละลายในน้ำ จะแตกตัวให้ไอออน ถ้าละลายได้ดีมากในน้ำ ละลายหมด ปฏิกิริยาจะ ไม่ เกิดภาวะสมดุล
- แต่ถ้าเป็นเกลือที่ละลายน้ำได้น้อยมาก ยังมีเกลือเหลืออยู่ สามารถเกิดภาวะสมดุลได้
- ถ้าปฏิกิริยาการละลายเขียนแทนด้วยสมการทั่วไปดังนี้
- AmBn (s)
 mAn+ (aq) + nBm- (aq)
mAn+ (aq) + nBm- (aq) - ค่า Ksp จะเขียนได้ดังนี้ Ksp = [An+]m [Bm-]n
- เช่น CaF2 (s)
 Ca2+ (aq) + 2F- (aq)
Ca2+ (aq) + 2F- (aq) - Ksp = [Ca2+] [F-]2
- ถ้าให้ a คือการละลายของ CaF2 เป็นโมล/ลิตร หมายถึง CaF2 ละลายได้ a โมล/ลิตร ดังนั้น จะให้ Ca2+ a โมล/ลิตร และ F- 2a โมล/ลิตร
- CaF2 (s)
 Ca2+ (aq) + 2F- (aq)
Ca2+ (aq) + 2F- (aq) - a 2a
- Ksp = (a) (2a)2 = 4a3 ค่า Ksp จะบอกให้ทราบว่าสารนั้นละลายได้มากน้อยเพียงใด
- ถ้า Ksp มีค่ามาก จะละลายได้มาก
- ค่า Ksp กับการตกตะกอน
- ค่า Ksp จะเป็นค่าที่กำหนดการตกตะกอนของสาร เช่น
- AgCl(s) (Ksp = 1.7x 10-10) ถ้า [Ag+] [Cl-] = Ksp AgCl จะเริ่มเกิดการตกตะกอน
- [Ag+] [Cl-] คือ ความเข้มข้นเป็นโมล/ลิตรของ Ag+ และ Cl- ในสารละลายขณะนั้น ซึ่งยังไม่มีตะกอนหรือของแข็งเกิดขึ้น ดังนั้นสรุปได้ว่า
- ถ้า [Ag+] [Cl-]
 Ksp (AgCl) AgCl ตกตะกอน
Ksp (AgCl) AgCl ตกตะกอน - [Ag+] [Cl-] < Ksp (AgCl) AgCl ไม่ตกตะกอน
- ร้อยละของการแตกตัว = ความเข้มข้นที่แตกตัว X 100
- ความเข้มข้นเริ่มต้น
- หมายเหตุ การแก้สมการหาค่า x ในสมการข้อนี้ ใช้สมการควอดราติก ax2 + bx + c = 0
- x =

ตัวอย่างสมดุลเคมีที่สำคัญ
สมดุลกรด-เบส
ปฏิกิริยากรด-เบสของกรดอ่อนหรือเบสอ่อนซึ่งเป็นปฏิกิริยาผันกลับได้นั้น การพิจารณาการแตกตัวของกรดอ่อนหรือเบสอ่อนมีความสำคัญมาก โดยค่าคงที่สมดุลของปฏิกิริยาการแตกตัวของกรดจะเรียกว่า ค่าคงที่การแตกตัวของกรด (acid dissociation constant, Ka)
- HA ⇌ A− + H+
โดยความหมายในทางเคมีของค่าคงที่นี้บ่งบอกความสมบูรณ์ของการแตกตัวของกรด หรือบอกความแรงของกรดนั่นเอง ซึ่งปกติแล้วค่าคงที่การแตกตัวของกรดมีค่าน้อยมาก จึงนิยมแสดงในรูปของค่า pKaซึ่งกำหนดให้เท่ากับ -log (Ka) ตารางต่อไปนี้แสดงตัวอย่างของค่าคงที่การแตกตัวของกรดอ่อนบางชนิด
-
สมดุล ค่า pKa H3PO4 ⇌ H2PO4− + H+ pKa1 = 2.15 H2PO4− ⇌ HPO42− + H+ pKa2 = 7.20 HPO42− ⇌ PO43− + H+ pKa3 = 12.37 [VO2(H2O)4]+ ⇌ H3VO4 + H+ + 2H2O pKa1 = 4.2 H3VO4 ⇌ H2VO4− + H+ pKa2 = 2.60 H2VO4− ⇌ HVO42− + H+ pKa3 = 7.92 HVO42− ⇌ VO43− + H+ pKa4 = 13.27
สมดุลการละลาย[แก้]
การละลายของสารประกอบไอออนิกในน้ำได้น้อยแล้วเกิดการแตกตัวเป็นไอออน จะอยู่ในสมดุลเคมีของการละลาย เช่น การละลายน้ำของเกลือแคลเซียมซัลเฟต ดังสมการต่อไปนี้
ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ของแคลเซียมซัลเฟตจะเป็น ดังนี้
เมื่อ K![]() ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ และคำนวณโดยใช้ค่าแอกทิวิตีของไอออนต่างๆในระบบ อย่างไรก็ตาม ของแข็งมีค่าแอกทิวิตีเท่ากับ 1 และเมื่อเราพิจารณาโดยใช้ความเข้มข้นของไอออนค่าคงที่จะเรียกว่า ค่าคงที่ผลคูณไอออน (ionic solubility product: Ksp)
ค่าคงที่ของการละลายทางเทอร์โมไดนามิกส์ และคำนวณโดยใช้ค่าแอกทิวิตีของไอออนต่างๆในระบบ อย่างไรก็ตาม ของแข็งมีค่าแอกทิวิตีเท่ากับ 1 และเมื่อเราพิจารณาโดยใช้ความเข้มข้นของไอออนค่าคงที่จะเรียกว่า ค่าคงที่ผลคูณไอออน (ionic solubility product: Ksp)
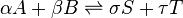
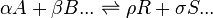

![K_c=\frac{{[R]} ^\rho {[S]}^\sigma ... } {{[A]}^\alpha {[B]}^\beta ...}](https://upload.wikimedia.org/math/5/6/4/56490b071626fb6d764365860fbba4f5.png)
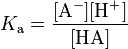

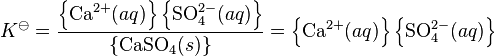
![K_{\mathrm{sp}} = \left[\mbox{Ca}^{2+}(aq)\right]\left[\mbox{SO}_4^{2-}(aq)\right].\,](https://upload.wikimedia.org/math/9/f/9/9f9d19ff487322a888ed709ef071964b.png)
ใส่ความเห็น